⚡ 13. 화학 전지의 원리 (다니엘 전지)
핵심 내용: 금속의 이온화 경향, 볼타 전지와 다니엘 전지, 염다리의 역할.
건전지를 넣으면 장난감이 움직인다. 도대체 건전지 안에서 무슨 일이 벌어지고 있는 걸까?
핵심은 전자($e^-$)의 이동이다. 전자가 이동하면 그것이 곧 전류가 된다.
화학 전지는 산화·환원 반응을 통해 화학 에너지를 전기 에너지로 바꾸는 장치다.
1. 전지의 기본 구성요소
전지가 작동하려면 반드시 두 명의 선수가 필요하다.
- 전자를 내놓고 싶은 놈 (산화 잘 되는 금속): 반응성이 크다.
- 전자를 받고 싶은 놈 (환원 잘 되는 이온): 반응성이 작다.
이 둘을 전선으로 연결하면, 전자가 (1) $\rightarrow$ (2)로 흐르며 전기가 발생한다.
이 원리를 가장 잘 설명해주는 교과서적인 모델, 다니엘 전지(Daniell Cell)를 뜯어보자.
2. 다니엘 전지의 구조와 원리
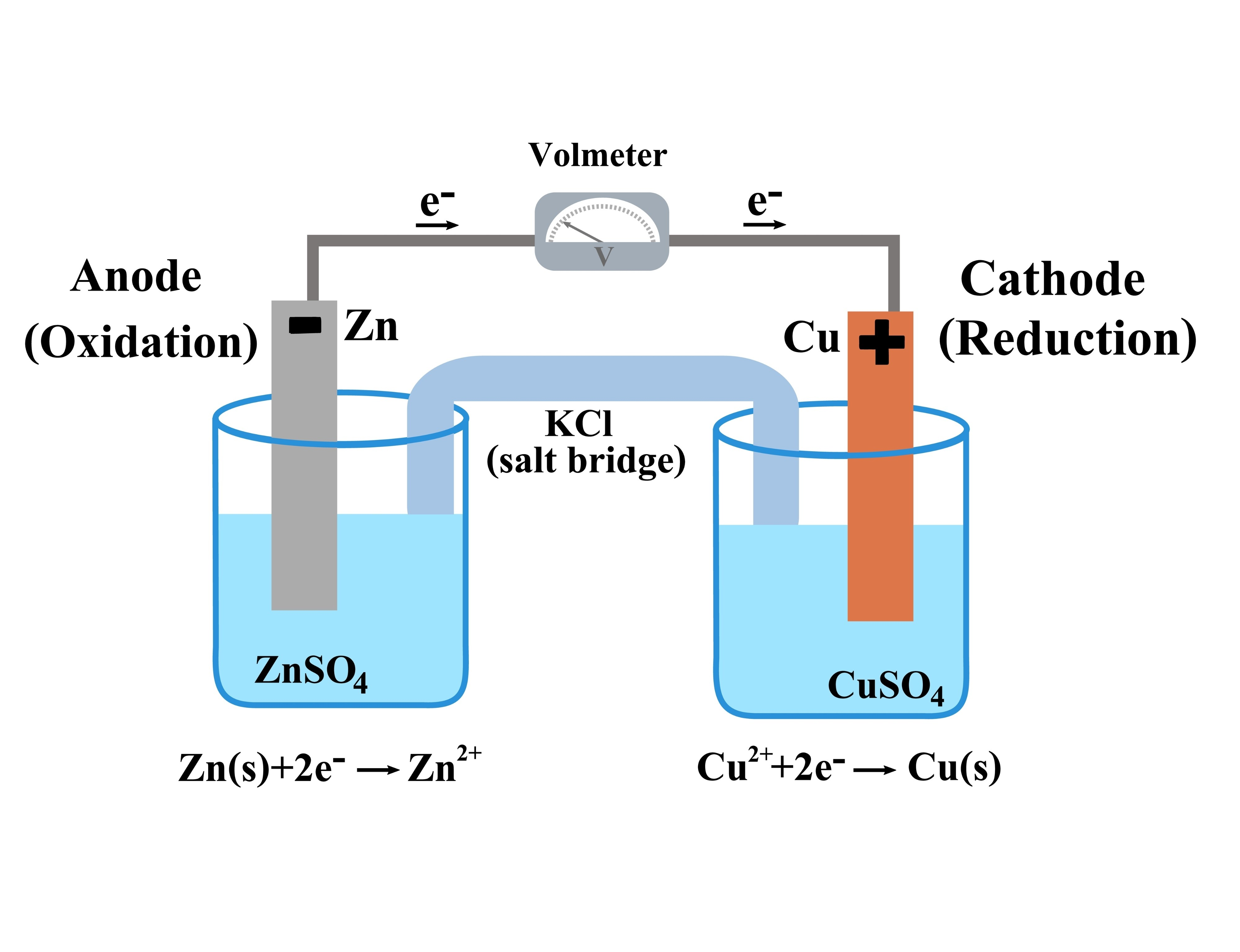
아연($Zn$)판과 구리($Cu$)판을 각각의 수용액에 담그고 도선으로 연결한 구조다.
① (-)극: 아연($Zn$) 전극 (산화 전극, Anode)
아연은 구리보다 반응성이 크다(이온화 경향이 크다). 즉, 전자를 버리고 이온이 되고 싶어 한다.
- 반응: 아연 금속이 전자를 잃고 녹아 나온다.
$Zn(s) \rightarrow Zn^{2+}(aq) + 2e^-$ (산화) - 변화:
- 아연판의 질량이 감소한다. (녹아버리니까)
- 용액 속에 $Zn^{2+}$ 이온이 많아져 (+)전하를 띠게 된다.
- 전자의 출발: 여기서 나온 전자가 도선을 타고 구리 쪽으로 간다. 그래서 (-)극이다.
② (+)극: 구리($Cu$) 전극 (환원 전극, Cathode)
반대편 비커에는 구리 이온($Cu^{2+}$)들이 둥둥 떠 있다가, 도선을 타고 넘어온 전자를 발견한다.
- 반응: 구리 이온이 전자를 받아 구리 금속으로 석출되어 달라붙는다.
$Cu^{2+}(aq) + 2e^- \rightarrow Cu(s)$ (환원) - 변화:
- 구리판의 질량이 증가한다. (표면에 구리가 코팅되듯 쌓임)
- 용액 속의 $Cu^{2+}$가 사라지므로 붉은색이 옅어지고, 상대적으로 (-)전하를 띠게 된다.
- 전자의 도착: 전자가 들어오는 곳이므로 (+)극이다.
💡 전체 반응식:
$$Zn(s) + Cu^{2+}(aq) \rightarrow Zn^{2+}(aq) + Cu(s)$$
3. 염다리(Salt Bridge)의 역할
위 그림에서 두 비커를 연결하는 'U'자 모양의 관이 보인다. 이것이 없으면 전지는 1초도 못 가서 멈춘다. 왜 그럴까?
- 문제 상황:
- (-)극 쪽은 $Zn^{2+}$가 쏟아져 나와 (+)전하가 쌓인다. (양이온 과잉)
- (+)극 쪽은 $Cu^{2+}$가 사라져서 (-)전하가 남는다. (음이온 과잉)
- 전기적인 불균형 때문에 전자가 더 이상 이동하지 못하게 된다.
- 염다리의 해결: $KNO_3$나 $KCl$ 같은 전해질을 채워 넣어 이온의 통로 역할을 한다.
- 음이온($NO_3^-$) $\rightarrow$ (-)극으로 이동하여 양이온 과잉을 해소.
- 양이온($K^+$) $\rightarrow$ (+)극으로 이동하여 음이온 과잉을 해소.
- 결론: 전하의 균형(전기적 중성)을 맞춰 전류가 계속 흐르게 해준다.
4. 전자와 전류의 흐름 방향
헷갈리기 쉽지만, 약속된 정의를 기억해야 한다.
- 전자의 이동 방향: (-)극 $\rightarrow$ (+)극 (아연 $\rightarrow$ 구리)
- 전류의 이동 방향: (+)극 $\rightarrow$ (-)극 (구리 $\rightarrow$ 아연)
- 양이온의 이동(염다리): (+)극 쪽 비커로
- 음이온의 이동(염다리): (-)극 쪽 비커로
🔑 암기 꿀팁: "안오드 산화 (An Ox), 캐소드 환원 (Red Cat)"
- Anode (산화 전극) = Oxidation
- Cathode (환원 전극) = Reduction
5. 전지식의 표현 (약속)
매번 그림을 그릴 수 없으니, 간단한 기호로 나타낸다.
$$(-) \ Zn(s) \ | \ Zn^{2+}(aq) \ || \ Cu^{2+}(aq) \ | \ Cu(s) \ (+)$$
- 순서: 산화 전극($-$) $\parallel$ 환원 전극($+$) 순서로 쓴다. (알파벳 순서 $A \rightarrow C$로 기억!)
- $|$ (싱글 바): 고체 전극과 수용액의 경계면 (상 경계)
- $\parallel$ (더블 바): 염다리 (Salt Bridge)
6. 핵심 요약
- 화학 전지: 산화·환원 반응으로 전기를 만든다.
- (-)극(산화): 반응성 큰 금속. 녹는다. 질량 감소. 전자 방출.
- (+)극(환원): 반응성 작은 금속 쪽 이온. 석출된다. 질량 증가. 전자 받음.
- 염다리: 이온을 이동시켜 전하 균형을 맞춘다. (없으면 작동 불가)
- 이동: 전자는 도선으로, 이온은 염다리로 다닌다.
'Chemistry > 심화' 카테고리의 다른 글
| 15. 전기 분해 (0) | 2025.12.11 |
|---|---|
| 14. 전지 전위와 실용 전지 (0) | 2025.12.11 |
| 12. 촉매와 반응 메커니즘 (0) | 2025.12.11 |
| 11. 반응 속도에 영향을 미치는 요인 (0) | 2025.12.11 |
| 10. 반응 속도의 정의와 측정 (0) | 2025.12.11 |



