⚡ 14. 전지 전위와 실용 전지
핵심 내용: 표준 환원 전위($E^\circ$)표 해석, 기전력 계산, 수소 연료 전지의 원리.
폭포의 높이 차이가 클수록 물이 세게 떨어지듯이, 전지에서도 두 전극 사이의 에너지 차이(전위차)가 클수록 전압이 세다.
이 에너지 차이를 화학에서는 전지 전위(기전력)라고 부른다.
1. 표준 환원 전위 ($E^\circ$)
모든 금속이 "내가 전자를 얼마나 좋아하는지"를 수치로 나타낸 성적표가 있다. 이것이 표준 환원 전위다.
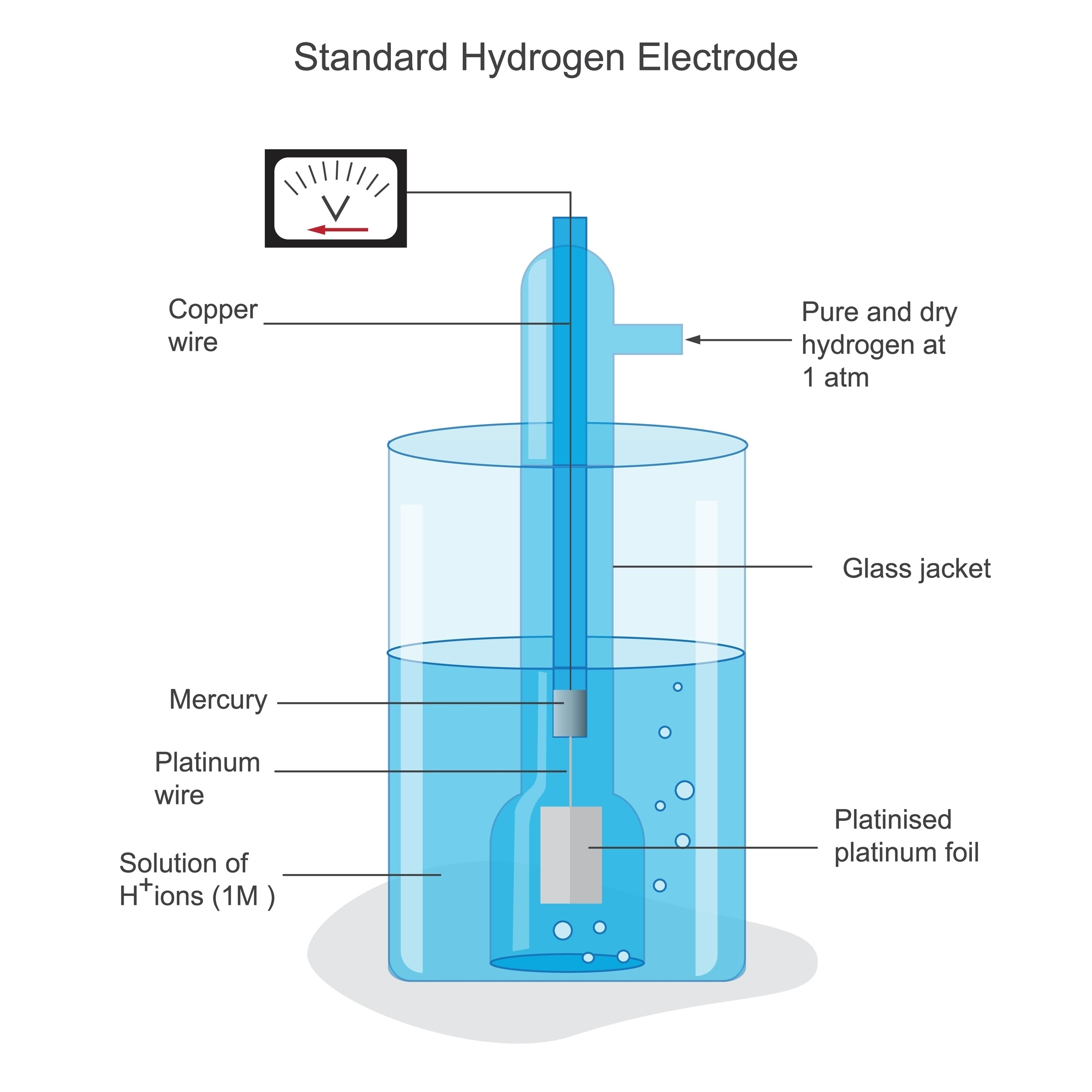
(1) 기준: 표준 수소 전극 (SHE)
전위의 절대적인 값은 알 수 없어서 기준을 정했다.
- $25^\circ\text{C}$, $1\text{atm}$, $1\text{M}$ 수소 이온($H^+$) 수용액에서 수소 기체가 환원되는 반응의 전위를 $0.00\text{V}$로 정했다.
- $2H^+(aq) + 2e^- \rightarrow H_2(g) \quad E^\circ = 0.00\text{V}$
(2) 표 해석 방법 (매우 중요)
수소보다 전자를 더 좋아하면 (+), 싫어하면 (-) 값을 갖는다.
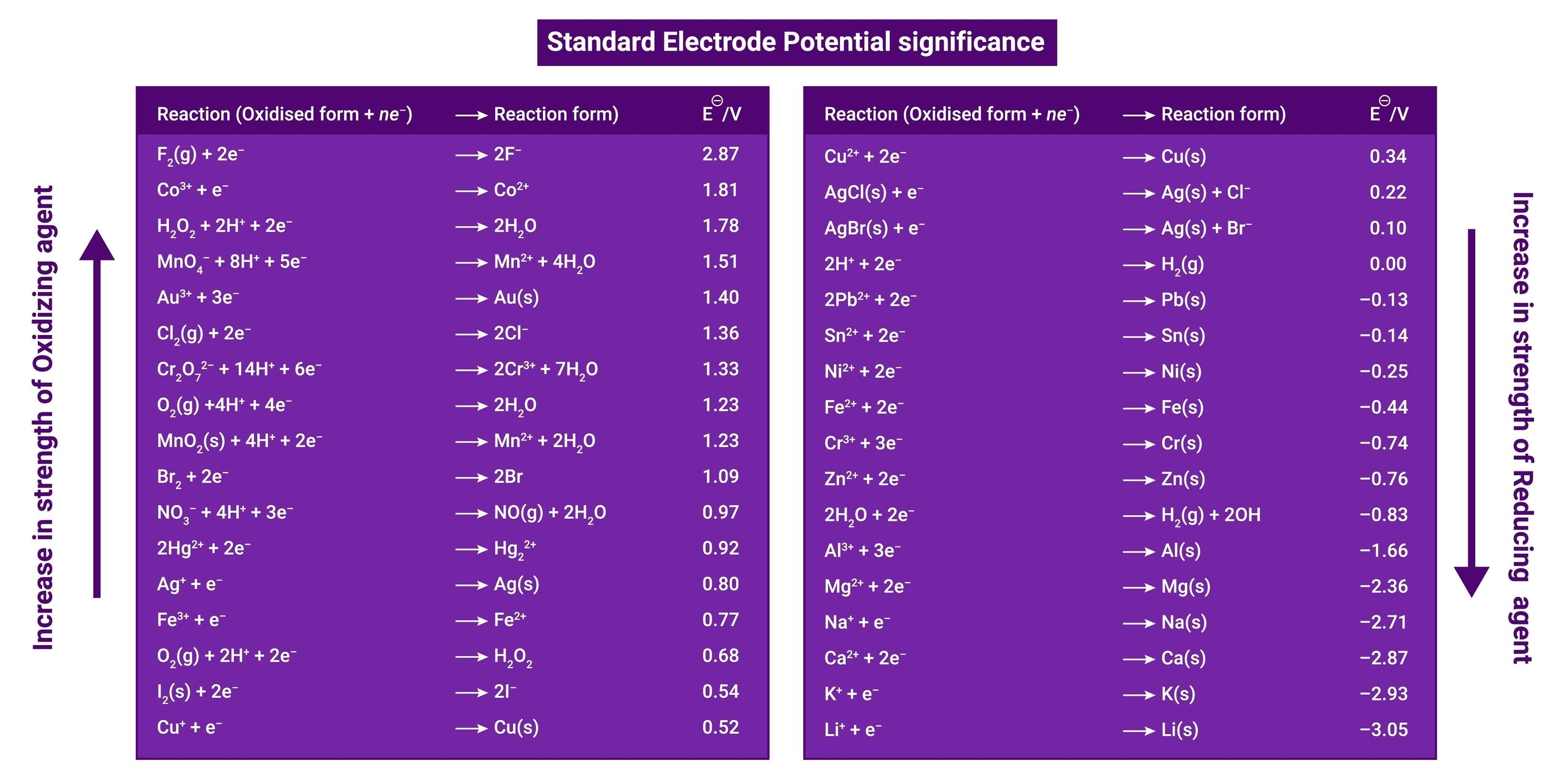
- $E^\circ$ 값이 클수록 (+):
- 전자를 잘 받는다 (환원되기 쉽다).
- (+)극이 되려는 성질이 강하다.
- 산화제로서의 힘이 세다. (남을 산화시키고 자기는 환원됨)
- 예: $F_2$, $Ag^+$, $Cu^{2+}$ 등.
- $E^\circ$ 값이 작을수록 (-):
- 전자를 잘 버린다 (산화되기 쉽다).
- (-)극이 되려는 성질이 강하다.
- 환원제로서의 힘이 세다. (남을 환원시키고 자기는 산화됨)
- 예: $Li$, $K$, $Na$, $Mg$, $Zn$ 등.
2. 표준 전지 전위 ($E^\circ_{cell}$) 계산
두 금속을 연결했을 때 전압이 얼마나 나올까? 공식은 아주 단순하다.
"큰 놈에서 작은 놈을 뺀다."
$$E^\circ_{cell} = E^\circ(\text{환원 전극}) - E^\circ(\text{산화 전극})$$
$$E^\circ_{cell} = E^\circ_{\text{cathode}} - E^\circ_{\text{anode}}$$
💡 예시: 다니엘 전지 ($Zn - Cu$)
- 표 확인:
- $Cu^{2+} + 2e^- \rightarrow Cu \quad (E^\circ = +0.34\text{V})$ $\rightarrow$ 값이 더 크다! (환원, +극)
- $Zn^{2+} + 2e^- \rightarrow Zn \quad (E^\circ = -0.76\text{V})$ $\rightarrow$ 값이 더 작다! (산화, -극)
- 계산:
$$E^\circ_{cell} = (+0.34) - (-0.76) = +1.10\text{V}$$- 의미: 이 전지는 $1.10\text{V}$의 전압을 낸다. 값이 양수(+)이므로 자발적으로 반응이 일어난다.
3. 실용 전지의 종류
우리가 실제로 쓰는 배터리는 크게 3가지로 나뉜다.
① 1차 전지 (Primary Battery)
- 특징: 한 번 쓰면 끝이다. 반응 물질이 소모되면 전압이 떨어져 재사용이 불가능하다.
- 예시: 망가니즈 전지, 알칼라인 전지(리모컨 건전지).
② 2차 전지 (Secondary Battery)
- 특징: 충전해서 다시 쓸 수 있다. 외부에서 전기를 거꾸로 걸어주면 역반응이 일어나 원래 상태로 돌아온다.
- 납축전지: 자동차 배터리에 쓰인다.
- (-)극: 납($Pb$) / (+)극: 이산화납($PbO_2$) / 전해질: 묽은 황산($H_2SO_4$)
- 무겁지만 튼튼하고 출력이 좋다.
- 리튬 이온 전지: 스마트폰, 노트북, 전기차에 쓰인다.
- 리튬 이온($Li^+$)이 양극과 음극 사이를 왔다 갔다 하며 전기를 만든다.
- 장점: 가볍고 에너지 밀도가 높다. 메모리 효과(용량 감소)가 없다.

③ 연료 전지 (Fuel Cell)
- 특징: 배터리라기보다 발전기에 가깝다. 연료(수소 등)를 계속 넣어주면 영구적으로 전기를 만든다.
- 수소 연료 전지:
- (-)극: $H_2 \rightarrow 2H^+ + 2e^-$ (수소가 전자를 내놓음)
- (+)극: $O_2 + 4H^+ + 4e^- \rightarrow 2H_2O$ (산소가 전자를 받음)
- 전체 반응: $$2H_2 + O_2 \rightarrow 2H_2O$$
- 장점: 배기가스가 없고 오직 물만 나온다. (친환경 끝판왕)

4. 핵심 요약
- 표준 환원 전위($E^\circ$): 값이 클수록(+) 환원되기 쉽고, 작을수록(-) 산화되기 쉽다.
- 전압 계산: $E^\circ(\text{큰 값}) - E^\circ(\text{작은 값})$. 양수(+)여야 전지가 작동한다.
- 1차 전지: 재사용 불가 (알칼라인).
- 2차 전지: 충전 가능 (납축전지, 리튬 이온). 역반응을 이용한다.
- 연료 전지: 수소와 산소로 전기 생산. 부산물은 물($H_2O$)뿐이다.
'Chemistry > 심화' 카테고리의 다른 글
| 15. 전기 분해 (0) | 2025.12.11 |
|---|---|
| 13. 화학 전지의 원리 (0) | 2025.12.11 |
| 12. 촉매와 반응 메커니즘 (0) | 2025.12.11 |
| 11. 반응 속도에 영향을 미치는 요인 (0) | 2025.12.11 |
| 10. 반응 속도의 정의와 측정 (0) | 2025.12.11 |



